En la foto: la testosterona, una hormona sexual que es producida por los varones y cuya función radica en el desarrollo de los genitales y en la manifestación de los caracteres sexuales secundarios. Imagen de MARIO OLAYA en Pixabay
Empezamos recordando las bases: la fórmula química
Cuando desarrollamos cada una de las fórmulas de la Nomenclatura Química Inorgánica habíamos dicho que cada una de estas estában basadas y fundamentadas en varias premisas, la primera de ellas era el número de electrones de Valencia que conforman a cada elemento y que participan en la formación de los enlaces covalentes, iónicos y metálicos (según fuera el caso), de ahí que se daba la gran variedad de compuestos posibles.
Ahora bien, lo anterior no es para nada ajeno a la Nomenclatura Química Orgánica. De entrada sabemos que el elemento carbono cuenta con cuatro electrones de Valencia, lo que le proporciona una versatilidad única en su tipo, de ahí que, no es de extrañarse que el número de compuestos que puede formar es muy superior a los compuestos inorgánicos.
Debemos de dejar muy en claro que una fórmula química bien construida debe de indicar los átomos y la proporción exacta en que se encuentran, esto se debe a que esa formula en particular se referirá a la composición de una molécula concreta.
Propiedades de los compuestos orgánicos basados en su estructura: los tipos de cadena
Gracias a la tetravalencia, el átomo de carbono puede formar moléculas complejas y diferentes, esto obviamente involucra al mismo elemento que es capaz de entrelazarse entre sí. Dependiendo de la longitud y estructura se podrá determinar las propiedades físicas tales como el punto de ebullición y la solubilidad. Pará el caso de los gases y líquidos es mu probable que nos encontremos con compuestos con una cadena corta, mientras que, los de cadena larga demostrarán su estado sólido.
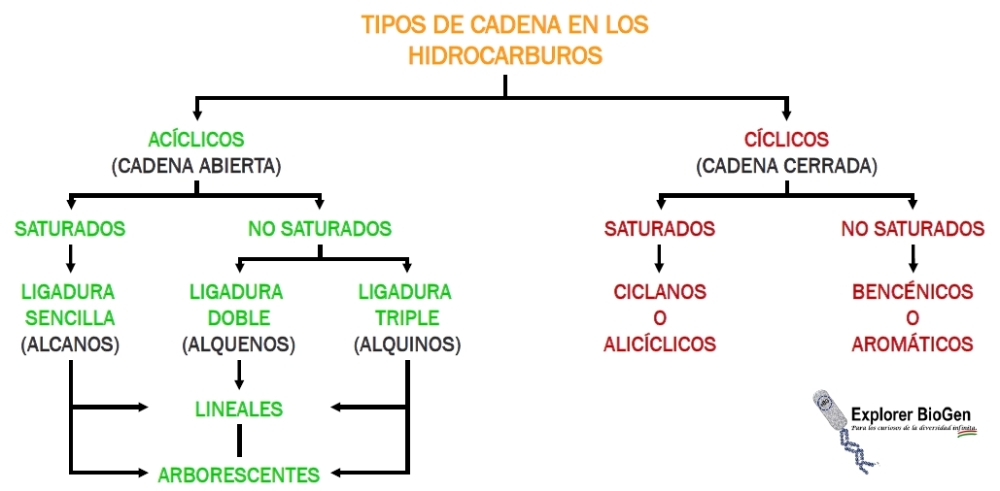
Ahora bien, ¿Con qué tipo de estructuras nos podremos encontrar?
Estructura acíclica: se trata de un esqueleto de cadena abierta.
Estructura cíclica: se trata de un esqueleto de cadena cerrada.
Estructura saturada: se trata de un enlace simple entre átomos de carbono, por lo tanto, estamos hablando de un alcano.
Estructura no saturada: aquí nos estamos refiriendo a los alquenos o alquenos (compuestos de doble o triple enlace).
Estructura homocíclica: se trata de una estructura cerrada conformada solamente por átomos de carbono.
Estructura heterocliclica: se trata de una estructura cerrada formada por algún átomo diferente al carbono tales como el Oxígeno (O), Nitrógeno (N), Azufre (S), Fósforo (P), entre otros.
Lineal: se trata de un esqueleto sin ramificaciones (arborescencias).
Estructura arborescente: se trata de un esqueleto con ramificaciones unidas a la cadena principal.
Estructura alicíclica: se trata de derivados alifáticos (hidrocarburos de cadenas abiertas o cerradas) que no contiene un anillo bencénico.
Aromático: se trata de un esqueleto cíclico de seis carbonos unidos mediante enlaces simples y dobles de manera alternada; son comúnmente conocidos como benceno.
Simple: se refiere a los esqueletos cíclicos sin arborescencias.
A continuación se resume brevemente los tipos de compuestos orgánicos (Fig. 1).
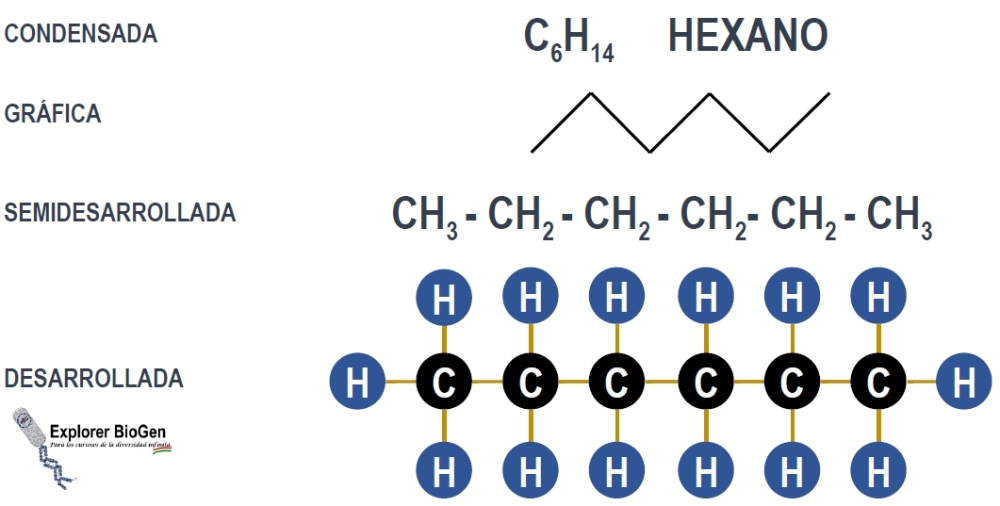
Tipos de fórmulas empleadas en la química orgánica
En química es imprescindible apoyarnos de fórmulas que nos ayuden a comprender la estructura molecular de los compuestos orgánicos. Podemos encontrar diferentes tipos de fórmulas estructurales tales como las desarrolladas, las semidesarrolladas, las gráficas y las condenadas. A continuación describiremos cada una.
Fórmula desarrollada
Esta fórmula indica a lujo de detalle todos los enlaces presentes en el compuesto, sin embargo, va resultando menos práctica conforme aumenta la masa molar.
Fórmula semidesarrollada
En este tipo de fórmulas se indican sólo los enlaces entre los átomos de carbono que constituyen el compuesto orgánico. Se omiten los enlaces del carbono respecto del hidrógeno u otros que pudieran estar presentes. Su utilidad es mayor respecto a la fórmula desarrollada.
Fórmula gráfica
Se trata de una de las fórmulas más empleadas puesto que se mantiene implícita la participación de los átomos del carbono y del hidrógeno, la representación de los dobles o triples enlaces es más obvia en este tipo de fórmulas. En algunos casos también se le denomina a esta fórmula como topológica.
Fórmula condensada o molecular
Estas se escriben sin mostrar todos los enlaces individuales. En estas, cada átomo central, el carbono, se muestra junto con los átomos que están unidos a él (Fig. 2).