Reacciones de alquenos
Las reacciones de alquenos son las reacciones químicas en las que participan los alquenos y les permiten su transformación en otras clases de compuestos orgánicos. La mayoría de las reacciones de alquenos son adiciones electrofílicas (AE), en las cuales los electrones del doble enlace C=C atacan la región de un compuesto que presenta densidad de carga positiva. Existen también reacciones que proceden por radicales libres o por mecanismos pericíclicos.
Reacciones de alquenos[editar]
Las principales reacciones químicas en la que participan los alquenos son:


1) Reacción de Simmons–Smith[editar]
Mediante la reacción con diclorometano en presencia de un catalizador zinc-cobre se produce un alquilciclopropano.[1]
2) Hidrogenación[editar]
La hidrogenación cis .....se produce por reacción con hidrógeno en presencia de un catalizador metálico (platino, paladio, níquel).[1]
3) Hidrohalogenación[editar]
La monohalogenación de alquenos se produce por reacción con halogenuro de hidrógeno en medio no acuoso. La regioquímica de la reacción es Markovnikov.[1]
4) Hidrohalogenación antiMarkovnikov[editar]
En presencia de peróxidos, la hidrohalogenación ocurre con regioquímica antimarkovnikov, la cual solo se cumple con el HBr por las condiciones de la reacción.[1] si'
5) Halogenación de alquenos[editar]
Por reacción con halógenos (X2) se produce dihalogenuros de alquilo.[1]
6) Formación de halohidrinas[editar]
La adición de halógenos en medio acuoso forma halohidrinas.[1]
7) Sulfatación de alquenos[editar]
Con ácido sulfúrico concentrado se producen sulfatos de alquilo. Estos pueden ser posteriormente hidrolizados a alcoholes, los cuales siguen la regla de Markovnikov.[1]
8) Oximercuración[editar]
Con acetato de mercurio en medio acuoso seguido de una reducción con borohidruro de sodio se obtiene un alcohol con regioquímica Markovnikov.[1]
9) Hidroboración[editar]
La reacción con diborano seguida por hidrólisis oxidativa con peróxido de hidrógeno en medio alcalino produce un alcohol antiMarkovnikov.[1]
10) Hidroxilación[editar]
Con tetróxido de osmio seguido del tratamiento con sulfito de sodio se obtiene un glicol. También puede ser obtenido por reacción con permanganato diluido a bajas temperaturas, sin embargo, hay una mayor probabilidad de que ocurra un clivaje oxidativo.[1]
11) Peroxidación[editar]
Por tratamiento con un peroxiácido se obtiene un epóxido u oxirano.[2]
12) Clivaje Oxidativo[editar]
En presencia de permanganato concentrado a altas temperaturas se produce el clivaje oxidativo del alqueno; obteniéndose: cetonas, aldehídos o ácidos carboxílicos con menor número de carbonos que el compuesto inicial.[1]
13) Polimerización[editar]
En presencia de catalizadores (como Ziegler-Natta) se produce la polimerización de los alquenos.
14) Adición de diclorocarbeno[editar]
Por reacción con cloroformo en medio alcalino se produce un derivado del 1,1-diclorociclopropano.[1]
15) Ozonólisis[editar]
Por ozonólisis con posterior clivaje oxidativo se obtienen aldehídos y cetonas.[1]
16) Hidroformilación[editar]
La hidroformilación del alqueno con monóxido de carbono, agua y un catalizador de cobalto a altas presiones y temperaturas produce un aldehído con un carbono más que el compuesto inicial.[3]
Reacciones con radicales libres[editar]
Reacción de Kharasch[editar]
La adición de Kharasch es una reacción que procede por radicales libres, catalizada por metales. Consiste en una adición de radicales libres de compuestos CXCl3 (X = Cl, Br, H) a alquenos.[4] La reacción fue propuesta por Morris S. Kharasch en los años 1940s.
Reacción de Wohl-Ziegler[editar]
La reacción de Wohl-Ziegler es una bromación alílica se lleva a cabo en presencia de N-bromosuccinimida (NBS).

Reacciones pericíclicas[editar]
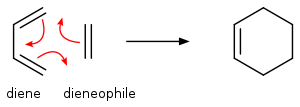
Los alquenos y dienos llevan a cabo numerosas reacciones pericíclicas, en los cuales se pueden obtener diversas estructuras cíclicas y con especificidad estereoquímica, tales como las cicloadiciones (adiciones [2+2], Reacción de Diels-Alder), electrociclizaciones, reacciones sigmatrópicas y reacciones de transferencia de grupo (tales como la transposición de Cope).


Referencias[editar]
- ↑ a b c d e f g h i j k l m McMurry, John (2004). «Alquenos: reacciones y síntesis». Química Orgánica (sexta edición). Thompson. pp. 208-237. ISBN 970-686-354-0.
- ↑ McMurry, John (2004). «Éteres y epóxidos. tioles y sulfuros». Química Orgánica (sexta edición). Thompson. pp. 648-649. ISBN 970-686-354-0.
- ↑ Yúfera, Eduardo Primo (1996). «Hidrocarburos III. Alquenos». Química orgánica básica y aplicada:de la molécula a la industria (Volumen 1). Reveté. pp. 158-159. ISBN 84-291-7953-4.
- ↑ Name reactions: a collection of detailed reaction mechanisms, Jie Jack Li Springer; 2nd edition (September 17, 2003) 3540402039
